Siguranța și tolerabilitatea RAVICTI®1,2
RAVICTI® (fenilbutirat de glicerină) este documentat complet pentru tratamentul tulburărilor ciclului ureei.
Cele mai frecvente reacții adverse raportate în studiile clinice (cel puțin 10% dintre pacienți) au fost:
- Pacienți adulți: diaree, flatulență, cefalee, greață, vărsături, scăderea poftei de mâncare, amețeli și oboseală
- Pacienți copii cu vârsta cuprinsă între 2 și 17 ani: dureri în partea superioara a abdomenului, erupții cutanate, greață, vărsături, diaree, scăderea poftei de mâncare și cefalee
- Pacienți copii cu vârsta cuprinsă între 2 luni și mai puțin de 2 ani: neutropenie, vărsături, constipație, diaree, pirexie, hipofagie, tuse, congestie nazală, rinoree, erupție cutanată și papule
- Pacienți copii cu vârsta mai mică de 2 luni: vărsături, erupții cutanate, reflux gastroesofagian, creșterea enzimelor hepatice, tulburări de alimentație (scăderea poftei de mâncare, hipofagie), anemie, tuse, deshidratare, acidoză metabolică, trombocitoză, trombocitopenie, neutropenie, limfocitoză, diaree, flatulență, constipație, pirexie, letargie și iritabilitate/agitație
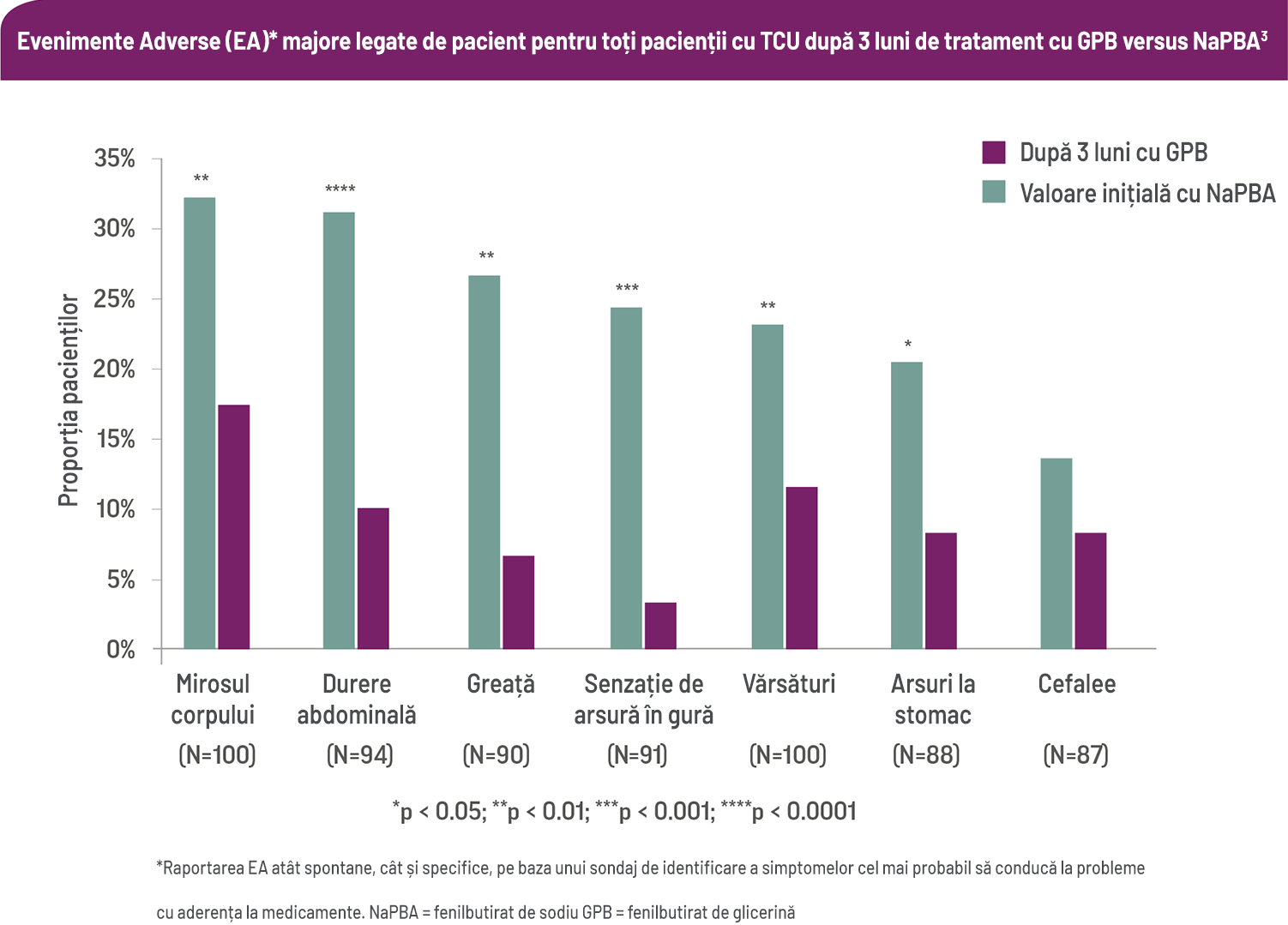
Evenimente adverse asociate tratamentului – RAVICTI vs NaPBA
O sută de pacienți sau îngrijitorii lor au răspuns la un chestionar nevalidat specific TCU, care include o listă predefinită de simptome comune asociate cu captatorii de azot. Valorile inițiale (în timp ce pacienții primeau fenilbutirat de sodiu [NaPBA]) au fost comparate cu valorile după trei luni de tratament cu fenilbutirat de glicerină (GPB).3
Atenționări și precauții speciale pentru utilizare
- Hipersensibilitate la substanța activă
- Tratamentul hiperamoniemiei acute
- Enzimele pancreasului exocrin hidrolizează fenilbutiratul de glicerină în intestinul subțire, separând fracțiunea activă, fenilbutiratul, de glicerină. Acest proces permite ca fenilbutiratul să fie absorbit în circulație. Cantitatea scăzută de enzime pancreatice, absența acestora sau bolile intestinale care determină malabsorbția lipidelor pot duce la un grad redus sau spre zero de digerare a fenilbutiratului de glicerină și/sau de absorbție a fenilbutiratului și la controlul redus al valorilor amoniacului. Valorile amoniacului trebuie monitorizate cu atenție la pacienții cu insuficiență pancreatică sau malabsorbție intestinală.
- Manifestări clinice reversibile care indicau neurotoxicitate (de exemplu greață, vărsături, somnolență) au fost raportate în asociere cu valori ale fenilacetatului cuprinse între 499 și 1285 μg/ml la pacienții cu cancer cărora li s-a administrat fenilacetat (PAA) intravenos. Deși acestea nu au fost observate în studiile clinice efectuate la pacienți cu TCU, trebuie suspectate valori crescute ale PAA la pacienții (în special la copiii <2 luni) cu somnolență, confuzie, greață și letargie inexplicabile, dar cu valori ale amoniemiei normale sau scăzute. Dacă simptomele de vărsături, greață, cefalee, somnolență, confuzie sau letargie sunt prezente în absența unor valori crescute ale amoniacului sau a altor boli intercurente, se va măsura valoarea concentrației plasmatice a PAA și a raportului PAA:PAGN (fenilacetilglutamină) și se va lua în considerare scăderea dozei de fenilbutirat de glicerină sau creșterea frecvenței administrării dozelor, dacă valoarea PAA depășește 500 μg/l, iar raportul concentrațiilor plasmatice ale PAA:PAGN depășește 2,5.
- Doza zilnică trebuie ajustată pentru fiecare pacient, în funcție de capacitatea estimată a pacientului de a sintetiza ureea, dacă această capacitate există, de profilul aminoacidic, de toleranța pacientului la proteine și de aportul zilnic de proteine necesare creșterii și dezvoltării. Pot fi necesare suplimente cu aminoacizi pentru a menține valorile normale ale aminoacizilor esențiali și ale aminoacizilor cu catenă ramificată. Ajustările suplimentare se pot baza pe monitorizarea valorilor amoniacului, glutaminei, UPAGN și/sau PAA și PAGN plasmatic, precum și ale raportului PAA:PAGN plasmatic (vezi pct. 4.2 din RCP).
- Corticosteroizi
Utilizarea corticosteroizilor poate duce la descompunerea proteinelor din corp și poate crește concentrația plasmatică de amoniac. Se recomandă monitorizarea cu atenție a valorilor amoniacului atunci când se utilizează concomitent corticosteroizi și fenilbutirat de glicerină. - Acid valproic și haloperidol
Hiperamoniemia poate fi indusă de acidul valproic și de haloperidol. Se recomandă monitorizarea cu atenție a valorilor amoniacului atunci când este necesară utilizarea acidului valproic sau a haloperidolului la pacienții cu TCU. - Probenecid
Probenecidul poate inhiba excreția pe cale renală a metaboliților fenilbutiratului de glicerină, inclusiv a PAGN.
- Femeile aflate la vârsta fertilă trebuie să utilizeze măsuri contraceptive eficace (vezi pct. 4.6 din RCP).
- RAVICTI nu trebuie utilizat în timpul sarcinii și la femei aflate la vârsta fertilă care nu utilizează măsuri contraceptive, cu excepția cazului în care starea clinică a femeii impune tratament cu fenilbutirat de glicerină, vezi pct. 4.6 din RCP.
Raportarea privind siguranța și reclamațiile despre produs
▼ Acest medicament face obiectul unei monitorizări suplimentare. Acest lucru va permite identificarea rapidă de noi informații referitoare la siguranță. Profesioniștii din domeniul sănătății sunt rugați să raporteze orice reacții adverse suspectate. Evenimentele adverse trebuie raportate la Immedica prin e-mail: safety@immedica.com
Dacă doriți să raportați o reclamație privind produsul, acest lucru trebuie făcut în conformitate cu cerințele naționale și în primul rând farmaciei dumneavoastră locale. De asemenea, puteți contacta Immedica Quality la: complaints@immedica.com
Referințe:
1. Raport de evaluare europeană RAVICTI.
2. Rezumatul Caracteristicilor Produsului RAVICTI.
3. Nagamani SC et al. Mol Genet Metab. 2015;116:29-34.

